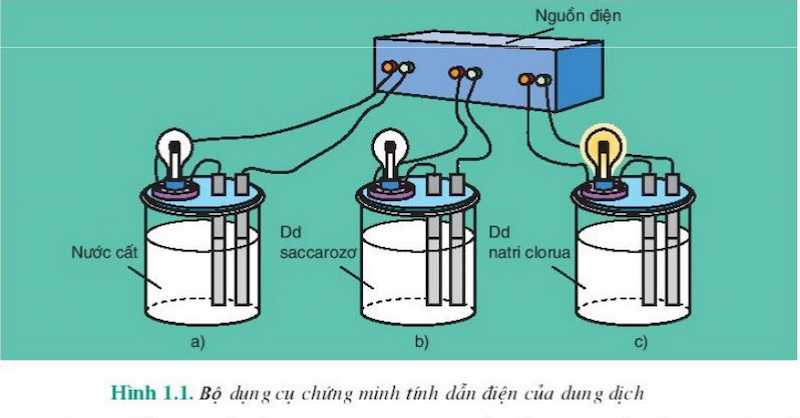
sự điện li là gì? chất điện li là gì? làm thế nào để phân biệt các chất điện li mạnh và điện li yếu? cùng mono tìm hiểu lý thuyết chi tiết và thực hành một số bài tập về sự điện li.
khái niệm sự điện li là gì? chất điện li là gì?
sự điện li (ion hóa) là qua trình phân ly các chất trong nước tạo thành ion âm (anion) và ion dương (cation). Đây là nguyên nhân khiến các dung dịch axit, spleen hay muối có thể dẫn điện được.
cụ thể hơn, đây là qua trình một nguyên tử hoặc phân tử tích một điện tích âm hoặc dương bằng các nhận thêm hay mất điện tán electron ể cán tán. qua trình này thường đi kèm nhiều thay đổi hóa học khác.
-
ion dương ược tạo thành khi chung hấp thụ ủ ủ ủ ủ nĂng lượng (lớn hơn hoặc bằng thế nĂng tương tac của Trong nguyên tử) gọi là electron tự do). năng lượng ion hóa là năng lượng cần thiết để diễn ra qua trình này.
-
ion âm ược tạo thành khi một electron tự do ập vào một nguyên tử mang điện hòa, ngay lập tức bị giữ lại và thiết lậràp h. nguyên nhân vì nó không đủ năng lượng để thoát khỏi nguyên tử này nữa, từ đó hình thành ion âm.
trường hợp điện li ơn giản là chất có liên kết ion hoặc có liên kết cộng hoá trị phân cực bị tách thành các ion riêt trong môi trư჻ìng n, lưhìn h.
chất điện li(chất điện giải, chất điện phân): là những chất tan trong nước (hoặc nóng chảy) phân li ra ion. chúng bao gồm: axit, spleen và muối.
sự điện li được biểu diễn bằng phương trình điện li.
video:
nacl → na+ + cl-
naoh → na+ + oh-
hcl → h+ + cl-
nguyên nhân tính dẫn điện của các dung dịch axit, spleen và muối
qua thực nghiệm năm 1887, a-rê-ni-ut kết luận rằng: các dung dịch axit, spleen và muối có khả năng dẫn điện ược do trong dung cáịcún dịch tún cún phân mang điện tích chuyển động tự do, còn gọi là các ion (bao gồm anion và cation).
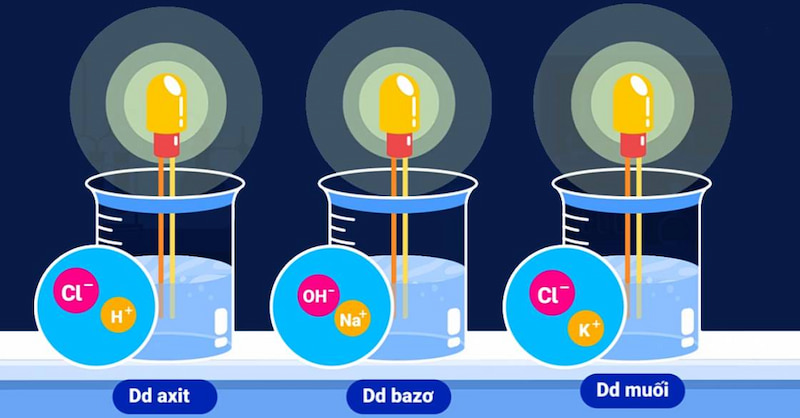
cụ thể, phân tử nước bị phân cực thành hai đầu âm và dương do nguyên tử oxi có độ âm điện lớn hơn nguyên tử hydro. do đó, cặp electron chung bị lệch về phía oxi. Vìy, khi một chất crar , tach cc cla ion, ion dion, thng thng với tử nước, tach cc cla ion, ion dion, thng thng với tử nước, tach cc cla ion, ion dion. (-) tách ra bởi nguyên tử oxi (mang điện âm) và ion âm (-) được tách ra bởi nguyên tử hydro (mang điện dương). liên kết các nguyên từ bị phá vỡ nên qua trình này có giải phóng năng lượng.
trong khi đó, các dung dịch như glixerol, đường saccarozo, ancol etylic không thể dẫn điện vì trong dung dịch chúng không phân li ra các ion âm và dương. nguyên nhân là do trong phân tử có liên kết phân cực nhưng rất yếu.
phân loại các chất điện li
Để phân loại các chất điện li, người ta làm thí nghiệm sau. chuẩn bị 2 cốc: hcl 0.10m, và ch3cooh 0.10m, lắp vào dụng cụ như hình. khi dẫn điện cùng một nguồn vào đầu dây dẫn, bóng đèn ở phía hcl sáng hơn bóng đèn phía dung dịch ch3cooh. như vậy, ta có thể kết luận: nồng độ ion trong hcl lớn hơn ch3cooh, nghĩa là số phân từ hcl phân li ra nhiều ion hơn.
dựa trên thí nghiệm này, người ta chia chất điện li thành 2 loại: chất điện li mạnh và chất điện li yếu.

chất điện li mạnh
khái niệm: chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion.
ví dụ về các chất điện li mạnh:
-
xit hcl, hno3, h2so4,…
-
spleen mạnh như naoh, koh, ba(oh)2 ca(oh)2,…
-
hầu hết các muối của axit mạnh và bazơ mạnh như nacl, kno3, kci, k2so4,…
trong phương trình điện li của chất điện li mạnh, người ta sử dụng mũi tên 1 chiều chỉ chiều của qua trình điệ>
ví dụ về phương trình điện li:
-
nacl là chất điện li mạnh, nếu trong dung dịch chứa 100 phân tử nacl hoà tan thì cả 100 phân tử này đều phân li ra ion. nacl → na+ + cl-
-
trong dung dịch na2so4 0,1m, vì sự điện li của na2so4 là hoàn toàn nên có thể tính ược nồng ộộ các ion do na2so4 phân li lần lượt na là 0,2m và 0,2m phương trình phân li: na2so4 → 2na+ +s04(2-)
chất điện li yếu
khai niệm: chất điện li yếu là chất khi trong nước chỉ có một phần số pHân tử hòa so phân li ra ion , phần còn lại vẫn tồn tại tửng phân tử tử Trong dung dung dung. /p>
ví dụ về các chất điện li yếu:
-
các axit yếu như các axit hữu cơ ch3cooh, axit hclo, h2s, he, hcn h2so3,…
-
các bazơ yếu như bi(oh)3, mg(oh)2, …
strong phương trình điện li của các chất điện li yếu, người ta sử dụng mũi tên 2 chiều.
ví dụ về phương trình điện li:
ch3cooh ⇌ ch3coo- + h+
mg(oh)2 ⇌ mg2+ + 2oh-
sự điện li của chất điện li yếu là một qua trình thuận nghịch. cân bằng điện li được thiết lập khi tốc độ phân li ion bằng với tốc độ kết hợp các ion thành phân tử. Đây là cân bằng động với hằng số cân bằng k và giống như mọi cân bằng khác, chúng tuân theo nguyên lí chuyển dịch cân bằng lg sa-tơ-li.
sự pha loãng có ảnh hưởng gì đến sự điện li? khi pha loãng dung dịch, các ion (+) và (-) của chất điện li rời xa nhau, ít có điều kiện va chạm để tạo lại phân tử khiến cho đđiến chon .
xem thêm: phản ứng trao đổi ion: Điều kiện xảy ra phản ứng và viết phương trình ion rút gọn
bài tập về sự điện li sgk hóa học 11 kèm lời giải chi tiết
Để giúp bạn đọc nắm chắc các kiến thức về sự điện li, sau đây là một số bài tập cơ bản trong sgk hợt i gi ti.

giải bài 1 trang 7 sgk hóa 11
các dung dịch axit như hcl, bazơ như naoh và muối như nacl dẫn điện ược, còn các dung dịch như ancol etylic, saccarozơ, glijerol không dẫn điện ưh àện.
lời giải:
trong dung dịch: các axit, bazơ và muối phân li ra các ion dương và ion âm chuyển động tự do nên dung dịch của chúng có khả năng dẫn đi.
ví dụ:
hcl → h+ + cl-
naoh → na+ + oh-
nacl → na+ + cl-
còn các dung dịch như ancol etylic, đường saccarozơ, glixerol không dẫn điện vì trong dung dịch chúng không phân li ra các ion dương và ion âm.
giải bài 2 sgk hóa 11 trang 7
sự điện li, chất điện li là gì? những loại chất nào là chất điện li? thế nào là chất điện li mạnh, chất điện li yếu? lấy thí dụ và viết phương trình điện li của chúng?
lời giải:
sự điện li là sự phân li thành các cation (ion dương) và anion (ion âm) của phân tử chất điện li khi tan trong nước.
-
chất điện li là những chất tan trong nước và tạo thành dung dịch dẫn được điện.
-
các chất là chất điện li như axit, các bazơ, các muối tan được trong nước.
-
chất điện li mạnh là những chất khi tan trong nước các phân tử hoà tan đều phân li ra ion.
video:
h2so4 → 2h+ + so4(2-)
koh → k+ + oh-
na2so4 → 2na+ + so42-
chất điện li yếu là những chất khi trong nước chỉc có một phần số phân tử hoà so phân li ra ion, pHần còn lại vẫn tồn tại dưới dạng phân tử trong dung dung dGh.
ví dụ: h2s ⇌ h+ + hs-
giải bài 3 sgk trang 7 hóa 11
viết phương trình điện li của những chất sau:
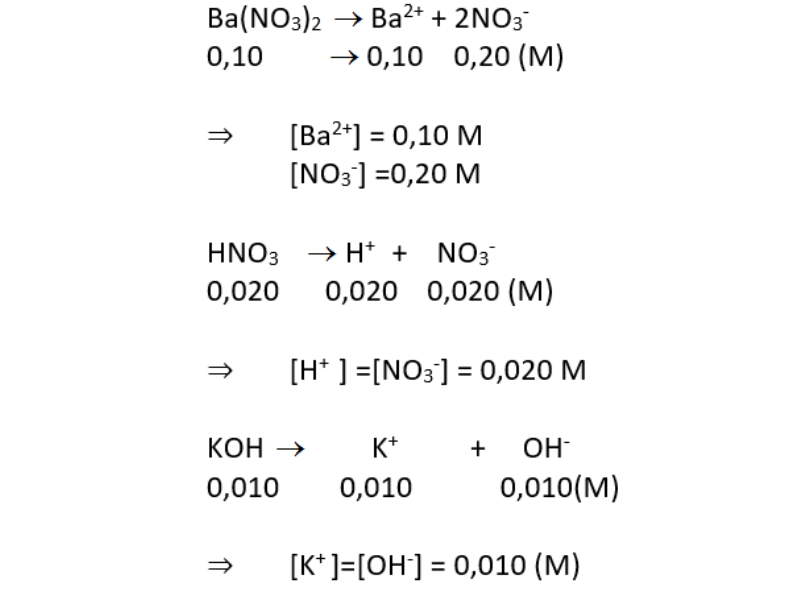
a. các chất điện li mạnh: ba(no3)2 0.10 m; hno3 0.020 m; koh 0.010 m. tính nồng độ mol của từng ion trong dung dịch.
b. các chất điện li yếu hclo; hno2.
lời giải:
a. các chất điện li mạnh:
b. các chất điện li yếu: hclo, hno2
hclo ⇌ h+ + clo-
hno2 ⇌ h+ + no2-
giải bài 4 trang 7 hóa 11 sgk
chọn câu trả lời đúng trong các câu sau đây:
dung dịch chất điện li dẫn được điện là do:
a. sự dịch chuyển của các electron.
b. sự dịch chuyển của các cation.
c. sự dịch chuyển của các phân tử hoà tan.
d. sự dịch chuyển của cả cation và anion.
lời giải: Đápán d.
do khi hoà tan (trong nước) các phân tử chất điện li phân li ra thành các cation và anion.
giải bài 5 hóa 11 sgk trang 7
chất nào sau đây không dẫn điện được?
a. kcl rắn, khan.
b. cacl2 nóng chảy.
c. naoh nóng chảy.
d. hbr hoà tan trong nước.
lời giải: Đápán a.
do kcl rắn, khan tồn tại dưới dạng mạng tinh thể ion rất bền vững. vì vậy, chúng không phân li ra được ion dương và ion âm (di chuyển tự do) nên không có khả năng dẫn điện.
như vậy, bài viết này đã giúp bạn ọc giải đáp các thắc mắc xung quanh sự điện li , bao gồm: sự điện li là gì, chấ là gì, chấ là gì. phân biệt các chất điện li mạnh và điện li yếu cùng một số bài tập thực hành về chủ đề này. mono hi vọng những thông tin này sẽ có ích cho bạn. Ấn “nhẬn cẬp nhẬt” để không bỏ lỡ nhiều kiến thức thú vị khác về môn hóa học mỗi ngày!
-
-
-
-